目に見えない極小粒子で、がん細胞を狙い撃つ
特定教授
玉野井 冬彦
Fuyuhiko Tamanoi
「がんを終わりにしたい」。私が研究を進める上でのモチベーションです。 長い歴史のなかで人類はがんに苦しめられています。シッダールタ・ムカジーが2011年に書いた『病の皇帝「がん」に挑む』がベストセラーになりましたが、副題に「人類4000年の苦闘」とあります。その4000年の苦闘に終止符を打ちたいのです。

1977 名古屋大学理学部博士課程修了(理学博士)
1977-1980 ハーバード大学医学大学院 博士研究員
1980-1985 コールドスプリングハーバー研究所 主任研究員
1985-1993 シカゴ大学 助教授
1994- カリフォルニア大学ロサンゼルス校 教授
2017- 京都大学アイセムス 特定教授
DNA研究からがん研究へ

私は最初からがんの研究をしていたわけではありません。もともとは分子生物学を専攻して、DNAやRNAの研究をしていました。コールドスプリングハーバー研究所にいた1980年ごろに分子生物学の研究から発がん遺伝子やがん抑制遺伝子が見つかり、そのころから自分なりのアプローチでがん研究に取り組んでみようと思いました。
当時取り組んでいたのは、分子標的薬の研究。がん細胞だけでなく身体に必要な細胞も殺してしまう抗がん剤ではなく、がん細胞の特的の分子だけを狙い撃ちする抗がん剤の開発を目指したのです。その標的になるものは、発がん遺伝子が関わっているシグナル伝達です。当時、乳がんに効くハーセプチンなど画期的な薬がでてきたのは確かですが、研究を続けているうちに、それだけではがんの治療は難しいなという気がしてきたのです。
なぜかというと、細胞のシグナル系はとても複雑だからです。たとえば、がん細胞と正常の細胞のシグナル伝達を比較すると、がん細胞は発がん遺伝子ができるためにあるシグナル伝達系が上がっている。そこでがん細胞を死滅させるにはそこを叩けばよいことになりますが、今度は別のシグナル伝達系が上がってしまう。一箇所を叩くと他のところが上がってしまってキリがないのです。
研究の糸口は肉眼では捉えられないナノ材料
そこで、もっと別の視点からアプローチしてみようと。着目したのはナノテクノロジーです。人間の目には見えないほど小さなナノ材料を使って抗がん剤を運び、がん細胞にアタックする。
たとえば、私たちの使っているメソポーラスシリカナノ粒子という材料は、ウイルスと同じくらいの大きさです。細胞の中に簡単に入っていく。それを血管に入れると、普通は血管から漏れません。でも、がんの部位では血管に穴が開いているので、そこから漏れる。血管中をぐるぐると回っているうちに、がん細胞に抗がん剤をたくさん集めることができます。薬剤を目的の場所へ届けることを「ドラッグデリバリーシステム」といいますが、このような手法でがん治療に取り組もうとしているのです。
メソポーラスシリカナノ粒子はもともと日本で1988年に開発された材料です。特徴としては「安定」であること。がん細胞までにたどり着くまでに2〜3日はかかるので、血管中に長く存在しないといけない。シリカナノ粒子はそれをクリアできるほど安定しています。とはいえ、長いあいだ身体の中に残ったら、予想もしない部分に蓄積してしまうかもしれません。それを克服するには生体内で分解できることも大事ですので、私たちで新しく生体内で分解される新規のメソポーラスシリカナノ粒子を開発しました。
もう一つは「多孔性」であること。無数の穴が空いているという意味ですね。穴の表面は外と繋がっているので、「たくさん穴が空いている」ということは「表面積が大きい」ということです。私たちが使っているメソポーラスシリカナノ粒子の1gあたりの表面積は100㎡です。1gでも駐車場ほどの広さがあるので、そこに抗がん剤を蓄積して直接がん細胞に届けることができるというわけです。
多孔性
シリカナノ粒子には無数の穴が空いています。これは「表面積が多い」ことを意味するので、そこに抗がん剤などをたくさん蓄積できます。1gあたりの表面積は100㎡もあります。

安定性
シリカナノ粒子を体内に入れることで、がん細胞の近くに薬剤を届けられます。血管中でもすぐに壊れずに存在でき、材料としての安定性が高いことが特徴です。

鶏の卵で個別化治療のハードルをなくす
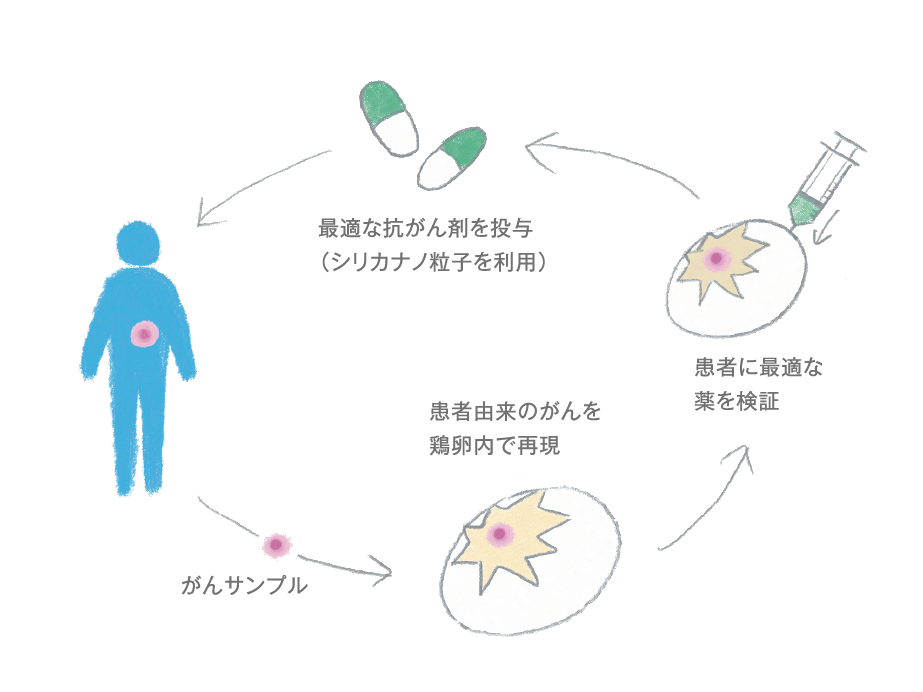
メソポーラスシリカナノ粒子を用いたがん治療を開発しながら、その治療の評価方法も同時に開発しています。「鶏卵モデル」という、鶏の卵を用いた患者由来のがんモデルの開発です。アイセムスにきてから本格的に開発に取り組み、2018年に発表しました。
がんの動物モデルを作るにはいろいろな方法がありますが、多くの人はマウスのモデルを利用します。しかし、マウスはがんモデルができるまでに数週間かかってしまい、時間も手間もかかる。その点、鶏卵モデルはとても速く、1週間ほどでできる。方法は患者さんから採取したがんの検体を細かく砕き、鶏卵の中の漿尿膜という膜の上にのせて待つだけ。とても簡単に作れます。
また、コスト面でも安価であることが特徴です。実験用マウスの値段は一概には言えませんが、およそ数万円の費用がかかるのに対し、鶏卵の有精卵は数十円ほど。圧倒的な安さで運用できます。
鶏卵モデルは導入のハードルが低いので、患者さんのがんモデルを作って薬剤を試してオーダーメイドの治療を行ったり、多様性のある希少がんのモデルを作って最適な薬を作ったりできるようになります。
100種類くらいのがんでテストしてみましたが、およそ7割は鶏卵モデルに生着しました。ほとんどの種類は作れるということだと思います。そこから抗がん剤をスクリーニングして、ある希少がんに効く抗がん剤を見つける実験を国立がんセンターと共同で始めたところです。
抗がん剤を使わず、がん細胞だけを死滅させる
抗がん剤をシリカナノ粒子の表面につけることに成功したので、ここ数年は他のものをつけて研究しています。
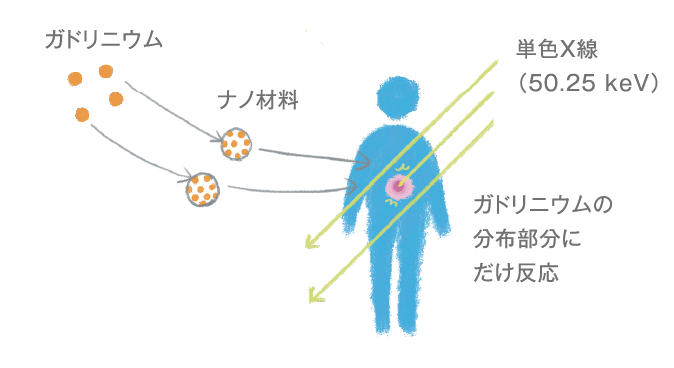
3年ほど前からガドリニウムに着目し、2019年に新しい放射線治療法を開発しました。
現在のX線治療は、さまざまなエネルギーを持ったX線の集合体を照射するので、がん細胞だけでなく周辺の健康な細胞にも悪影響を及ぼしてしまいます。でも、単一のエネルギーを持った単色X線を用いればターゲット以外への影響を少なくできます。
その問題を、ナノ粒子を用いてどうにかできないかと考えました。まず、私たちが開発したメソポーラスシリカナノ粒子にガドリニウムを担持させて、がんに集積させる。そこに特殊なX線(50.25 keV)を当てると、がん細胞の中でガドリニウムから電子を叩き出せて、がんを死滅させることができることがわかりました。つまり、健康な細胞を傷つけることなくピンポイントでがん細胞にアタックすることができるのです。
単色X線を用いるというアイデアは、金やガドリニウムなどの高Z元素にX線を照射すると電子が原子の電子軌道から叩き出されるという「オージェ効果」をベースに考えました。特殊なX線を用いる必要があるので、兵庫にある大型放射光施設SPring-8で実験しています。
自分の心に従って突き進んだら、いつの間にか研究者に
父親が経済学者だったこともあり、幼い頃から場所を転々としながら過ごしてきました。生まれは仙台で、東京育ち。10歳のころは、父の仕事の影響で一年間だけアメリカで暮らしたこともあります。異文化に触れて、とても貴重な体験ができました。幼いながらアメリカはいろいろな可能性があり、自分のしたいことが実現できる場所だと感じました。日本に戻ってからも「いつかアメリカに行ってやろう」と思っていました。
サイエンスに興味をもったのは高校生の時です。分子生物学の教科書を読んでDNAやRNAの奥深さを知りました。当時は分子生物学という学問が始まったばかりでとても盛り上がっていたので、食い入るように読んでいましたね。とはいえ、高校時代はラグビーに夢中でしたから、勉強はあまりしていませんでした。(笑)

東京大学生物化学科に入ってからは研究まっしぐらでした。当時は研究室に江上不二夫先生がおられました。三菱生命科学研究所を作った方で、分子生物学のパイオニアのような存在です。江上先生が退任されるときの学生でしたから、私は先生の最後の学生ということになりますね。
研究室の後任に就いたのが、岡崎令治先生でした。DNAの「岡崎フラグメント」の発見という、分子生物学においてとても重要な仕事をされました。その後、岡崎先生はもともと在籍されていた名古屋大学に戻られたので、私も名大に移り博士号を取りました。
当時の大学院は、そこに入ればもう一人前の研究者として認められ、自分の頭で考えて動くことが当たり前という雰囲気でした。私も同僚も「研究者として自分で道を切り開いてやろう」という野心がありましたから、博士号を取得したらほとんどの人が欧米に渡っていました。
私はアメリカに発ちました。幼い頃の念願が叶ったかたちになりましたね。ふつうは数年後に日本に戻ること多いですが、私だけが40年以上あちらに行ったままになってしまった(笑)。いま振り返ると、気付いたら研究者になっていたというかんじです。
長期にわたるアメリカでの研究生活を経て、再び日本へ
アメリカに発って最初はハーバード大学でDNAの研究を続けていました。ニューヨークにあるコールド・スプリング・ハーバー研究所に移った後にがん研究に切り替えたことはさきほど述べたとおりです。DNAの研究をしていたらヒトの発がん遺伝子がそこで最初に見つかったのです。とても感銘を受けて、がんは分子生物学的にアプローチできるとわかり、自分なりのアプローチを考え始めました。
その後はシカゴ大学を経て、UCLA(カリフォルニア大学ロサンゼルス校)に移りました。いまもアイセムスの仕事と兼任していますから、もう二十年以上は在籍していることになります。
UCLAの人たちはみんな気軽にサイエンスの議論をします。カリフォルニアの天候が気持ちよいのも影響しているのかな。みんな建物の中にこもらず、外に出る。すると誰かに会うから、1日外を歩いているとあらゆることがわかるのです。よいアイデアがあれば共有する環境があります。研究をするには理想的な環境です。
ほかにもアメリカと日本の研究環境はかなり違うなと感じるところはあります。一番感心したのは、教授が調べ物をしていてわからないことがあると学生に電話して聞くこと。学生も教授に気軽に質問しています。たとえば、『細胞の分子生物学』を執筆されたブルース・アルバーツ先生に会いに行ったときのこと。私が訪問したタイミングでちょうど分子生物学の教科書を書いていました。「気になることがあるから、ちょっと待ってくれ」と言うので、黙って見ていたら、一箇所だけ不明点があるから研究室の学生に電話していたのです。教授と学生の間に敷居がまったくない。アメリカではそんなことが非常にスムースにいきますね。それに慣れているから、私は今でも何か気がつくと学生にすぐ電話をしちゃう(笑)。

もちろん、アメリカでの研究はプラスもあるけどマイナスもあります。それは意外とオリジナルな研究が育ちにくいということ。本当に斬新なアイデアは日本から出ているケースが多いと私は理解しています。たとえば多孔性のシリカ材料も1988年に早稲田大学の黒田一幸先生らが発見された。重要なアイデアは日本から出ているのであれば、オリジナルの研究をされている方々に直接お話をしたほうがいいのではないか。そう思い、日本に目を向け始めました。
アイセムスは拠点が設立されて間もないころから縁があり、アイセムスの研究者と活発に意見交換をしていましたから、当時から交流は深かったです。がん研究を進める理想的な環境・施設が京都大学にそろっていることもあり、2017年にアイセムスにやってきました。
がんの革新的な治療法は、世界を変える

がんは人類が抱える深刻な問題です。身近な人ががんで亡くなってしまった経験をされた人は少なくないでしょう。とくに家族ががんにかかると、ものすごく辛い思いをしないといけない。そういう状況を目にすると、「サイエンスの力でなんとかしないと……」といつも考えます。新しいがんの治療方法ができたら、がんで若くして亡くなる人が減ったら、世界は変わるかもしれない。だからこそ、私の研究人生のすべてを捧げてでも、がん研究でできることはとことんやりたい。
普通の細胞ががん細胞に変わるプロセスは、ある種のがんではわかっています。例えば大腸がんはステージによって遺伝子の発現が変わり、それでがんになることがわかっている。それが理解できても、治療まではまだ遠いです。
そういう意味で、鶏卵モデルで治療に役立つ抗がん剤を見つけるアプローチに取り組んでいます。がん細胞を理解するだけでは、やっぱりだめ。治療ができて、治らないと意味がないと思います。
患者のがんを鶏卵のモデルで作り、抗がん剤を探すところまではいけると思いますが、その後に実際の臨床現場を説得するところも残っています。そこは病院のお医者さんと徹底的に議論をしないといけない。今はそこまでいけていないので、そこまでいけないかなと思っているところです。新しい治療ができて、がんを治ったという実績を残すことが目標です。かなり近いところまできているので、もう一息です。