世紀をこえてリバイバル!
生命の謎をひもとく メカノバイオロジーの可能性
私たち人間をはじめ生物の体を構成する細胞や組織はどのようにして形を変えたり、あるいはその構造を保ったりすることができるのでしょうか。まだまだ知られていない生物の謎を解き明かす学問があります。その名は「メカノバイオロジー」。1世紀も前に問題提起されたメカノバイオロジーはここ10年間で飛躍的に発展し、組織や細胞にはたらく物理的な力の役割が少しずつあきらかになりつつあります。この問題に取り組むiCeMSの研究者が、その魅力と展望をご紹介します。
杉村薫 特定拠点准教授
すぎむら・かおる
1978年に兵庫県に生まれる。京都大学大学院理学研究科生物科学専攻博士後期課程修了。博士(理学)。日本学術振興会特別研究員、理化学研究所研究員をへて、iCeMS特定助教に。2017年から現職。

中澤直高 特定助教
なかざわ・なおたか
1984年に群馬県に生まれる。東京理科大学大学院基礎工学研究科生物工学専攻博士後期課程修了。博士(工学)。日本学術振興会特別研究員、シンガポール国立大学メカノバイオロジー研究所研究員をへて、2017年から現職。

どうして力学?
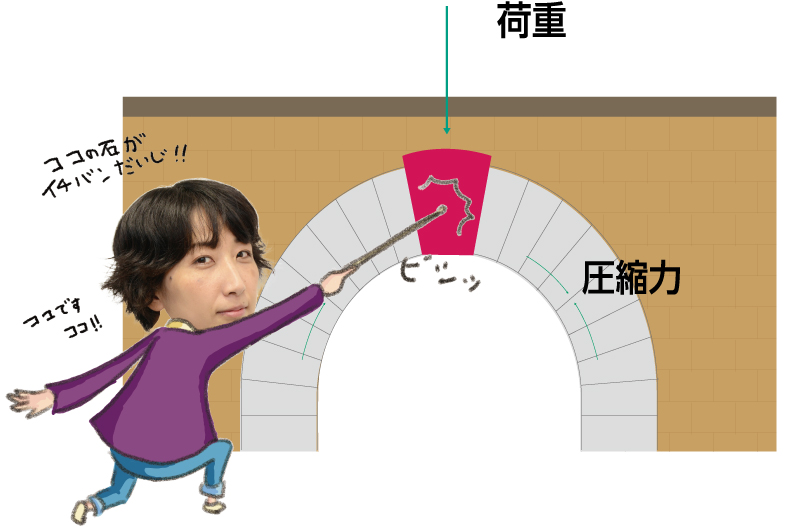
メカノバイオロジーは、細胞の内外で発生する力が、細胞や組織の活動にどのように影響を及ぼすのかを研究する学問です。キーワードは「力」。生物の体のいたるところで「力学」が働いているのです。たとえば、細胞は自らの足場を蹴ることで、作用反作用の力が働き、身動きができます。また、繊毛の運動により、卵子や受精卵は卵管内を輸送され、異物は気道内から排除されます。このように力学的な観点で捉えないと、生体内で起こっているできごとを科学的に説明できません。生命のメカニクスを詳細に解明すると、私たちの体のしくみが理解できるようになり、生きていない「物」との違いがわかる日がくるかもしれません。

硬い地面では速く走れるが、ぬかるみでは遅い。それは細胞もいっしょ。自らの足場を蹴ることで、身動きができる。
はじまりは約100年前─メカノバイオロジーの歴史
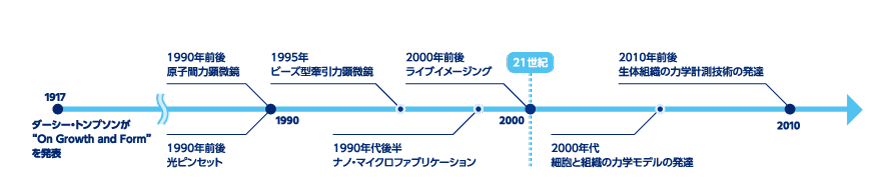
メカノバイオロジーは新しい分野と見なされていますが、その起源は古く、約100年前まで遡ります。1917年、生物学者のダーシー・トンプソンが “OnGrowth and Form”(『生物のかたち』)を発表。動植物の構造や形が形成される過程には物理や数学のロジックを適用でき、生物の形態と機械的な力には関連があることを提唱しました。しかし、当時の技術では詳細に研究することはむずかしく、トンプソンの提起した問いはしばらく眠りにつくことになります。21世紀前後に、力学計測技術、蛍光イメージング、微細加工技術などの自然科学の多くの分野で研究の視点や技術の転換が同時多発的に生じて、生命現象と機械的な力との関係を分子レベルで詳細に研究できるようになりました。現在、諸分野の知見や技術が総力をあげて導入され、研究の加速度はぐんぐんと上がっています。トンプソンの問いは1世紀の時をこえて「メカノバイオロジー」としてよみがえり、研究者たちはあらためてその謎に挑戦しているのです。
メカノバイオロジーのレンズでのぞいてみたら……
21世紀以降に発達した高度な技術をもちいて生命を力学的な視点で観察した結果、細胞や組織を新たな考え方で捉えることができつつあります。その一部を紹介しましょう。メカノバイオロジーのレンズをとおして世界をみると、これまでの常識を覆す発見ができるかもしれません。
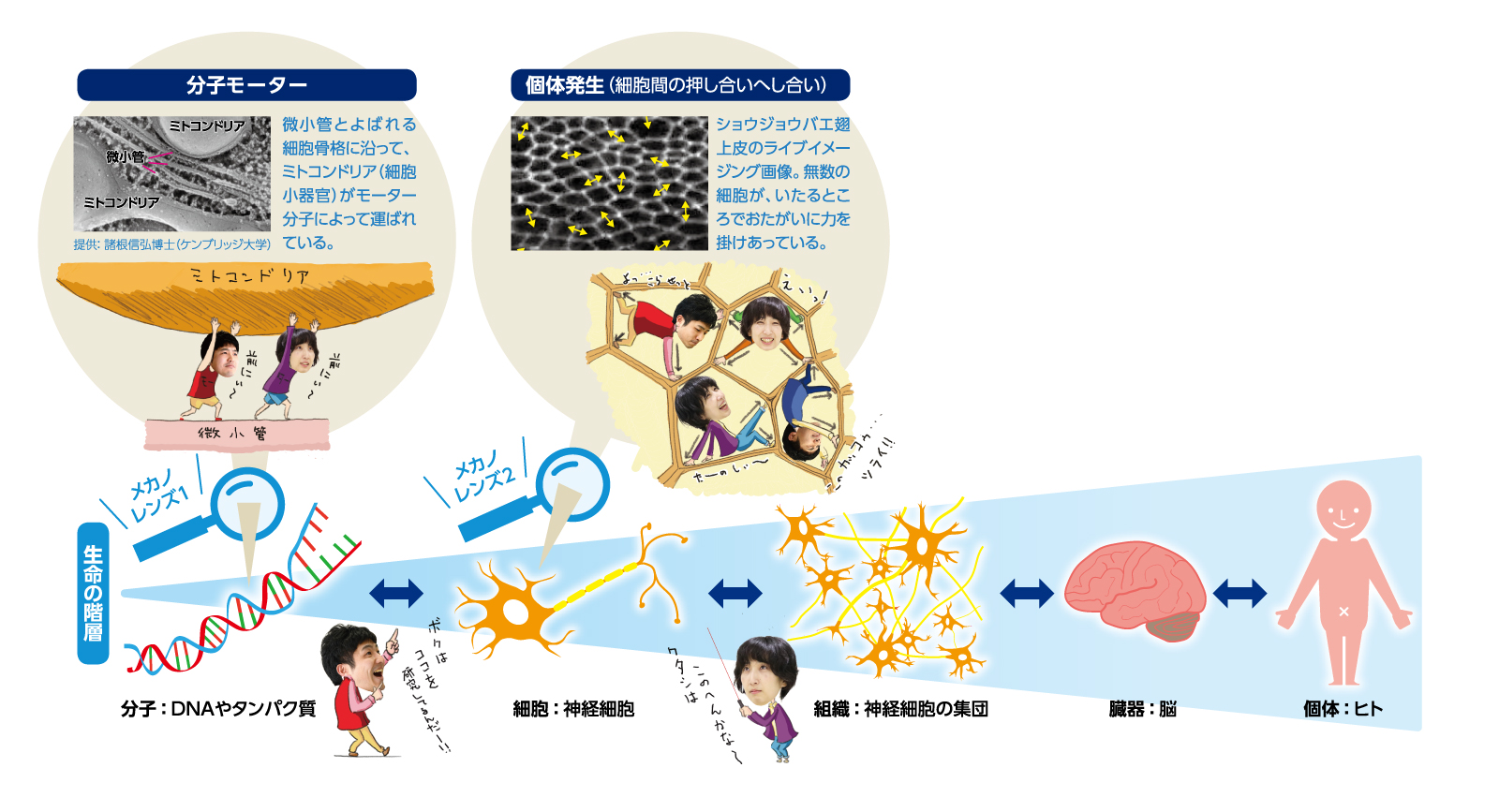
体のなかで力はどう働いている?
私たちの体は約37兆個の細胞によって構成されています。細胞は集合して組織や器官をつくり、これらがさらに集合して個体(人体)となるのです。こうした人体の構成は階層構造で表すことができます。細胞のなかでは分子モーターが働き、細胞は変形・移動することで、力を生み出します。その力を受けた細胞たちは、おしくらまんじゅうのように互いに押し合いへしあいしながら力をかけ合い、隣の細胞に作用します。細胞間で力を生み出し、感じ、応答を繰り返すことで、さらに次の階層に影響を与えています。メカノバイオロジーの研究では、分子や細胞などのミクロの視点のみならずマルチスケールな観点で、その機能や構造をとらえる必要があります。
細胞の運命は環境が決める細胞の分化
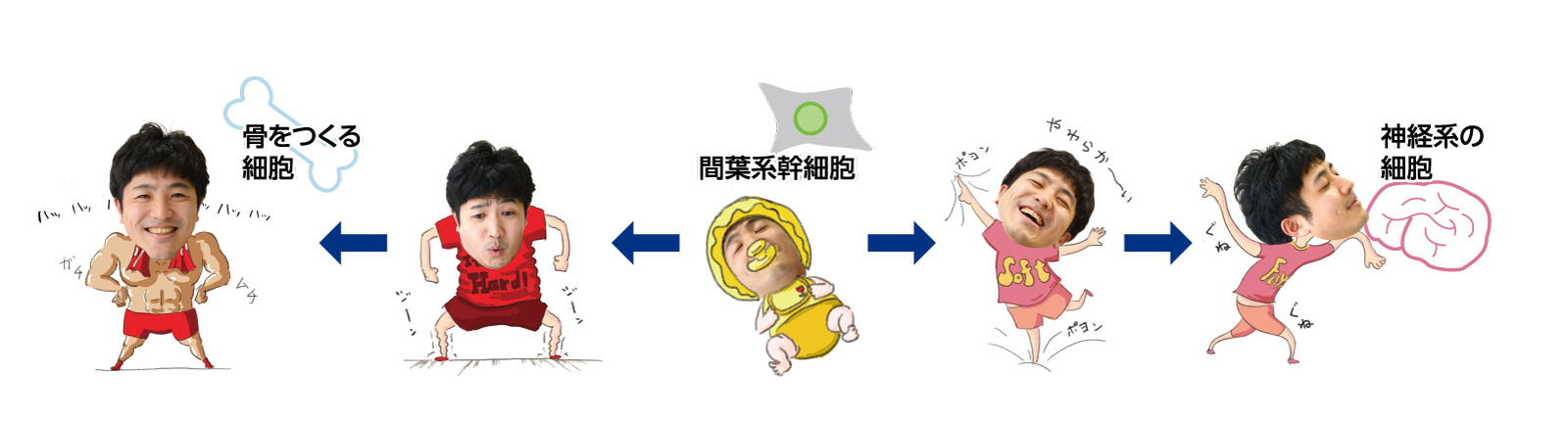
細胞は力を感じるだけでなく、周囲の組織の「硬さ」を感知して応答を変えます。たとえば間葉系幹細胞は骨や筋肉、血管などの細胞に分化することから、再生医療への応用が期待されていますが、細胞を支える「基質の硬さ」の違いにより、異なる種類の細胞に分化することが2006年にあきらかになりました。具体的には、基質を柔らかくすると神経細胞に、硬いと骨に、その中間は脂肪になります。細胞が機械的なシグナルとして検知した基質の硬さは、細胞内で生化学的なシグナルなどに変換され、その情報は核に伝達されます。それにより、遺伝子発現が調節され、細胞の分化に影響を与えるのです。これは周囲の環境がもつ力学的な特性が、細胞の運命を左右することを意味します。
どうやって研究するの?研究手法・技術の紹介
メカノバイオロジーの研究を進めるには、細胞や分子のふるまいを精密に調べる必要があります。研究の手法・技術はさまざまですが、ここでは観る、測る、整えるという3つの視点でその一部を紹介します。
観る(ライブイメージング)
生体組織や細胞が生きた状態で、そのはたらきや遺伝子が発現するようすを可視化し、外部から観察できる技術です。緑色の蛍光を発する性質をもつたんぱく質(GFP)などを生きた細胞やタンパク質に目印として付けることで、蛍光顕微鏡などで生体組織内の細胞やタンパク質のふるまいをライブで観察できます。

整える(微細加工技術)
ポリジメチルシロキサンやポリアクリルアミドなどの高分子材料は、その表面を細胞の足場となるタンパク質でコートすることで、細胞を接着できるようになります。このとき、架橋剤の割合を変えることでさまざまな硬さの足場を作れます。微細加工された基板と組み合わせることで、細胞の接着パターンを変えたり、細胞が通る流路などを作ったりできます。


測る
サンプルに直接触る方法(マイクロピペット法)
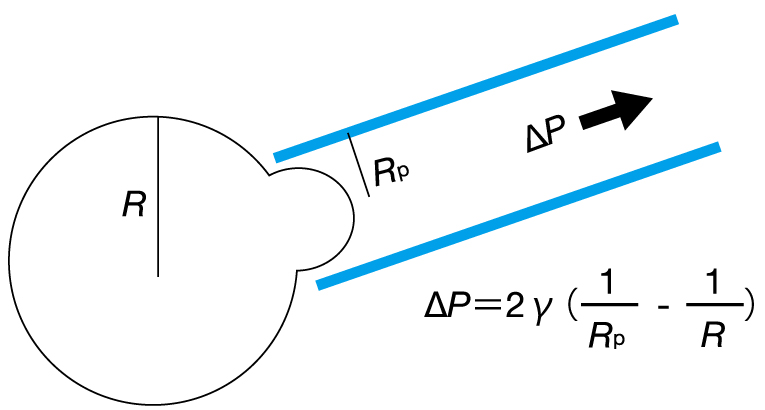
マイクロピペットの開口部を細胞や組織などのサンプルに接触させて引く力をかけると、サンプルはピペットのなかに吸い込まれます。サンプルの変形から、表面張力の絶対値を計測できます。
組織にセンサーを入れて測る方法(油滴法)
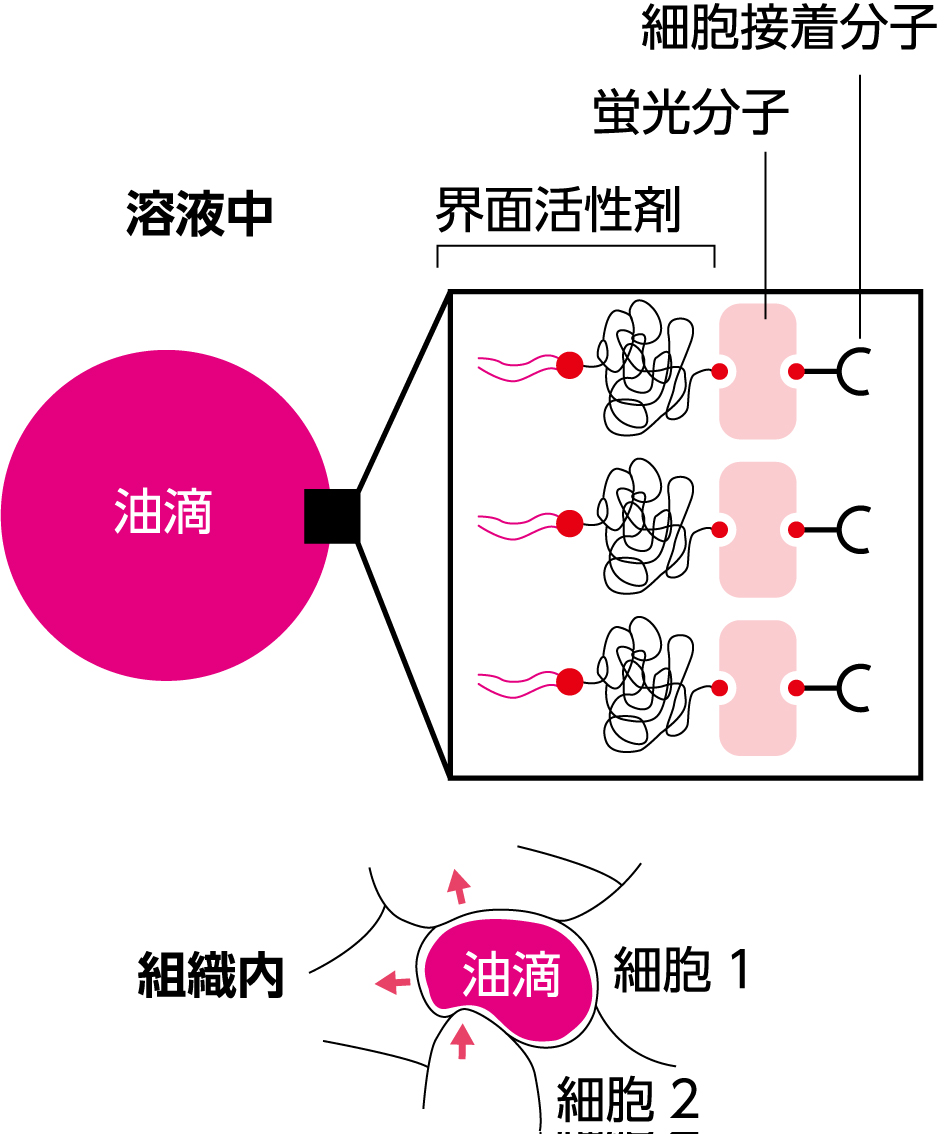
油滴を細胞と細胞のすきまに入れると、周囲の細胞から作用する力で油滴が変形します。あらかじめ溶液中で油滴の表面張力を測ることで、周囲の細胞から作用する力を計算できるのです。
COLUMN

定量データとは
数値によって計測、集計、分析が可能なデータのことを「定量データ」といいます。上記の技術を駆使すると、複雑な生命のしくみを解析するための定量データを得ることができます。メカノバイオロジーの分野に限らず、現象を科学的に理解するには、個人の主観的な感想や漠然とした情報ではなく、客観的かつ詳細な数値が必要です。研究者たちは、日ごろから膨大な定量データの収集、比較、分析を行うことで、理論モデルを形成したり、未知の領域を発見したりできるのです。
アイセムスの取り組み
iCeMSでメカノバイオロジーの研究に取り組む研究者たち。「力学」を観点に、生命のしくみを解き明かしたいという熱意はいっしょですが、それぞれ扱うスケールは異なります。いったいどんな研究を行っているのでしょうか。
田中 求 特任教授
(iCeMS-CiMPhy)
私たちの身体には筋肉や骨、神経など「硬さ」の異なる組織があり、それらのもととして働く細胞やその周りの環境(細胞外基質)の硬さもそれぞれ異なります。このような細胞周辺の「硬さ」や「向き」などの性質を、測ったり計算したりするのは物理の得意とする分野です。私たちは「硬さや向きを自在に変えられる材料」を使って、細胞をとりまく環境の変化が「健康な細胞が病気になる」というような細胞の働きや運命に与える影響を、医学・生物の研究グループと協力してあきらかにしています。

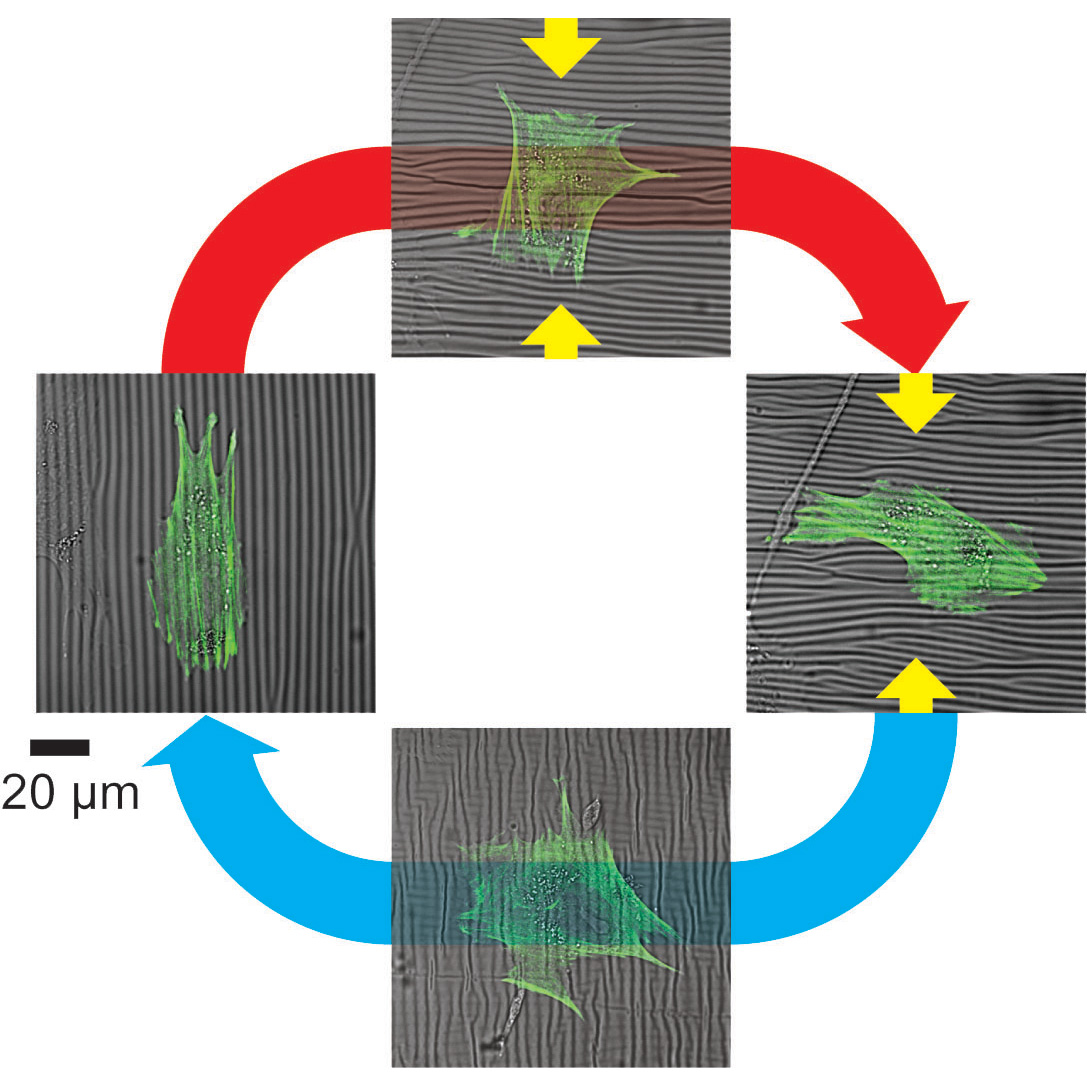
中澤直高 特定助教
(見学グループ)
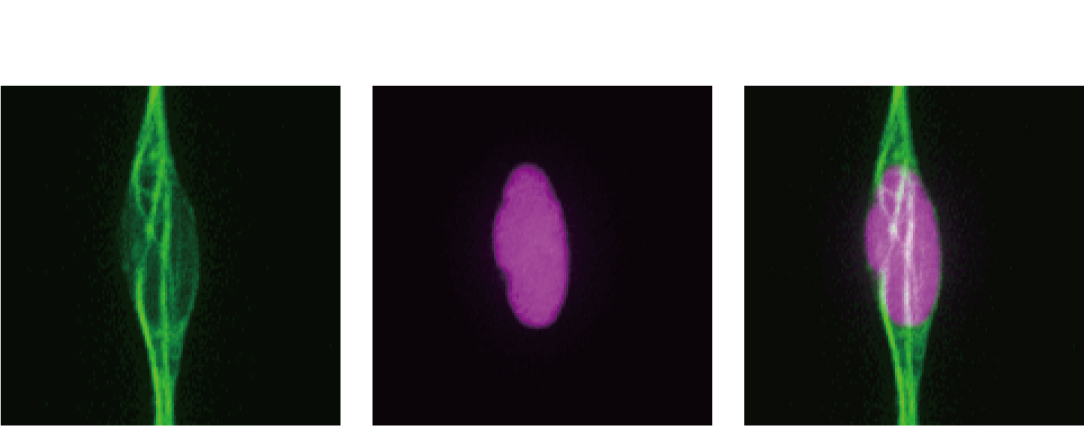
脳発生過程において、新しく生まれたニューロン(神経細胞)は神経突起が複雑に絡み合った微小な空間をかいくぐりながら、生まれた場所から機能する場所まで移動します。この過程で、ニューロンは機械的な力を用いてどのように微小な空間をすり抜けるのか、そのときに受ける機械的ストレスに対してどのように応答するのか、などの点に関して多くの謎が残されています。私たちは、ニューロンが神経組織内を移動する際の細胞核の動きに着目し、これらの謎の解明に取り組んでいます。

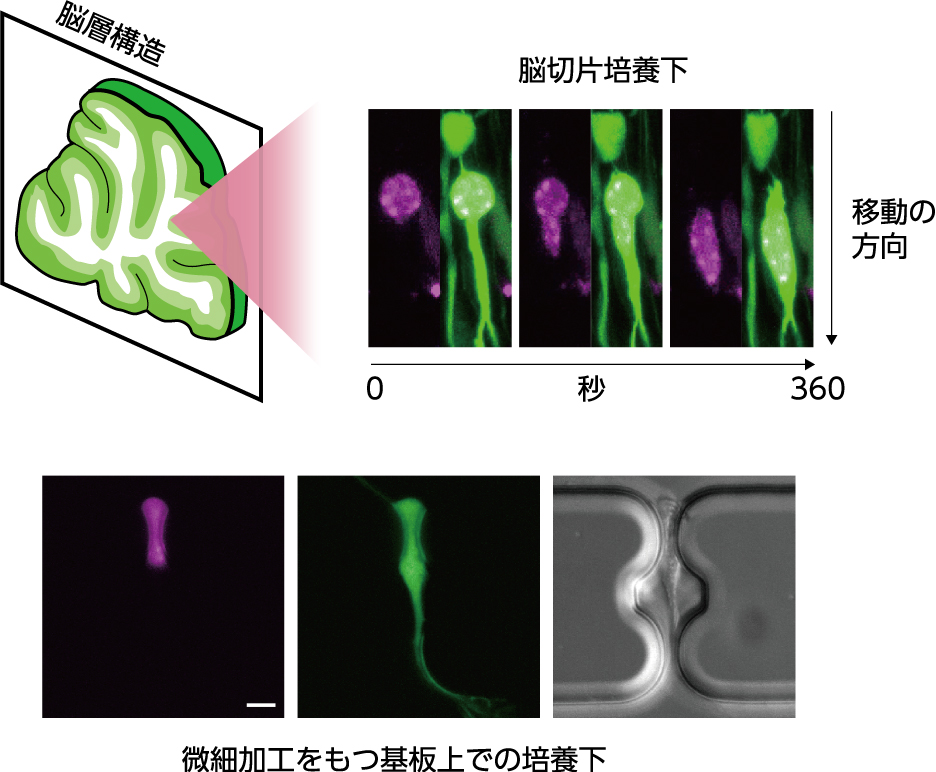
杉村 薫
特定拠点准教授
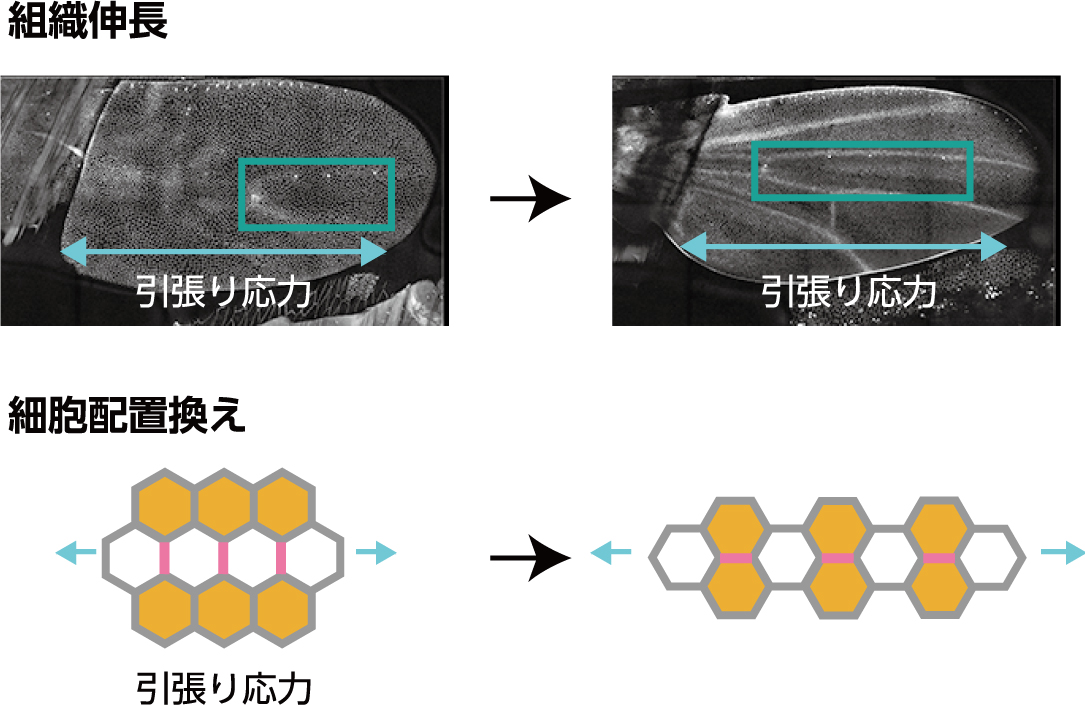
ヒトをふくむあらゆる多細胞生物は、「個体発生」とよばれるプロセスを通じて精緻なかたちを備え、複雑な機能を実現する身体を獲得します。個体発生の過程では、機械的な力が変形の駆動力として必須の働きをします。私たちは、物理学と数理統計学、ライブイメージングを組み合わせて、個体発生の過程で働く「見えない力」を「見えるかたち」から推定する手法を開発しました。開発した手法をハエの翅に適用し、機械的な力が細胞間の情報のやり取りを担うメッセンジャーとしても働くことを見出しました。

2019年3月発行 iCeMS Our World, Your Future vol.7 から転載
制作協力:京都通信社