『観る』がつなぐ、「細胞生物学」と「材料科学」
サイエンスにおいて「光」は欠かせないツール。光の種類は短い波長から長い波長まであり、それらを応用する技術や視点も分野により異なる。
アイセムスでは近年、光を扱う研究成果が多く出ている。それらの一部を紹介するとともに、細胞生物学と材料科学の視点から光を用いて「観る」ことの魅力に迫る。

杉本邦久
特定准教授
すぎもと・くにひさ
1972年生まれ。近畿大学大学院化学研究科化学専攻博士課程修了。博士(理学)。京都大学客員准教授を経て、2019年より現職。
藤原敬宏
特定准教授
ふじわら・たかひろ
1968年生まれ。東京大学大学院総合文化研究科広域科学専攻博士課程満期退学。博士 (理学)。京都大学再生医科学研究所特任助教などを経て、2008年にアイセムス助教に。2017年より現職。
パブリックエンゲージメントユニット(以下、PE)「光」と一言で言っても、分野により扱う光の波長や技術が大きく異なると思います。まず、お二人がどの光を使って、どのような研究を行っているかについてご紹介いただけますか。
可視光で1分子を見るための技術を開発し、
今まで見えなかった現象を可視化する
藤原
僕の研究では、可視光を光源とした光学顕微鏡を使います。
生物学の歴史を紐解くと、光学顕微鏡を使って小さいものを拡大して見ることで、いろいろな発見がもたらされました。おそらくレンズを組み合わせることで何か大きく見えたのが起源で、そこで最初に光源として使われたのが、可視光の波長を含む太陽光でした。光を使った技術の開発や理論は、まず可視光の波長で発展してきました。
可視光を使った光学顕微鏡がよいのは、生物の研究をするのにとても手軽なツールであることです。僕が大学院で生物学を専攻したときに面白いと思ったのが、顕微鏡で細胞を拡大してみたら、中で何かいろいろ動いているのが見えたことでした。細胞が生き生きと働いているのを観察できることに感動しました。
PE 光学顕微鏡を使って、現象をじっくり観られるのがよいと。

藤原
はい。僕の専門は1分子イメージングです。普通の方法では見えない分子1個の運動を顕微鏡で観察します。細胞の中でどのように分子1個が働いているかを調べるためにはいろいろな工夫が必要でした。
何もしなければ生体分子1個は光が通り抜けて透明なので、これを観察できるように標識してやる必要があり、僕が最初に用いたのは金コロイドです。数10ナノメートルサイズの小さな微粒子を使い、金属が光を通さずに散乱する性質を利用して、分子1個の運動を細胞の表面で見られます。
2000年頃からGFP(緑色蛍光タンパク質)が使えるようになり、化学合成した蛍光色素もいいものが出てきたので、生体分子1個と同じくらいか、それより小さいサイズの蛍光プローブで標識できるようになってきました。
また、高出力で安定な可視光レーザー光源や、開口数が大きく、高い光を集める能力をもった対物レンズが利用できるようになり、弱い光を検出できる高感度カメラの開発も進みました。それで、金コロイドの技術を発展させつつ、1個の蛍光プローブを細胞の中で見るための要素技術が整ったところで、それを組み合わせた「蛍光1分子観察の技術開発」にシフトして現在に至っています
PE 蛍光のプローブ開発、顕微鏡の技術の発展のおかげで、ようやく見たいものを見る環境が整ってきたということですね。1分子イメージングを行うために欠かせない技術はなんでしょう?
藤原
細胞で蛍光1分子を見るのに特に有効だったのが、「全反射蛍光顕微鏡法」という技術です。この技術も2000年頃に実用化されました。観察対象の細胞をカバーグラスに培養して、カバーグラスから100ナノメートルくらいまでだけを照明できます。僕は細胞膜の機能に興味があるので、細胞膜に近い分子だけを見ることができるこの技術はとても都合がよかったのです。それで、全反射蛍光顕微鏡法をベースとした1分子イメージングの技術開発と、細胞膜の構造と機能の研究にこれまでずっと取り組んできました。
今後もさらに技術開発を進めることで、細胞膜分子の運動やそれによる信号伝達、メゾスケールの機能構造形成など、今まで見えなかった現象を可視化してその原理を究明したいと思っています。
PE 挙げていただいた技術はそれぞれ違う領域の開発だと思うのですが、それらを一手に藤原先生が取り組まれているのですか?
藤原
1分子を見るための要素技術の特性を生かすというか、組み合わせを調べて、全体としてのシステムの性能を向上させることが僕の主な仕事です。個別の技術開発という意味では、カメラのメーカーと一緒に高感度カメラの開発に取り組んでいます。
技術的には高速で観察することに特に集中しています。高速になって初めて見えてくるものや現象がたくさんあります。例えば、細胞膜の内側には膜骨格と呼ばれるアクチン線維の網目があって、その仕切りの中で細胞膜分子の運動が閉じ込められることで、様々な機能の制御を受けていることが高速観察で初めてわかりました。
生きている細胞内の1分子がはたらく瞬間を捉える
細胞膜には様々な機能ドメイン(ex.細胞外の物質を細胞内へ輸送する)やシグナル伝達に関わるような分子複合体があります。これらの構造を構成している膜タンパク質や脂質と呼ばれる分子がメゾスケール(5-100nm)で起こっている現象を理解することは、細胞機能を理解するために非常に重要であるため、1分子イメージングを行っています。
①高空間精度、高時間精度で1分子の挙動を追跡
②波長の違う色素(蛍光色素とGFP)を標識に
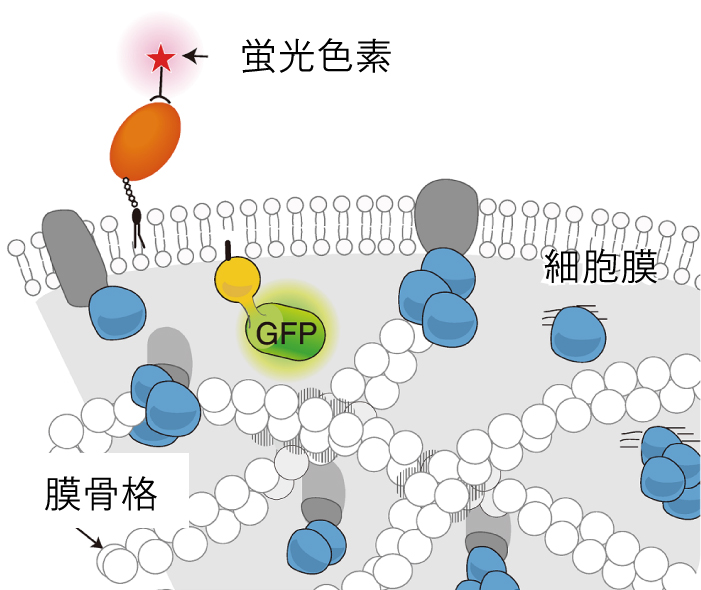
放射光施設のX線を用い、原子の構造を解析する
PE 藤原先生の可視光に対し、杉本先生が使われているのは目に見えないX線ですね。
杉本
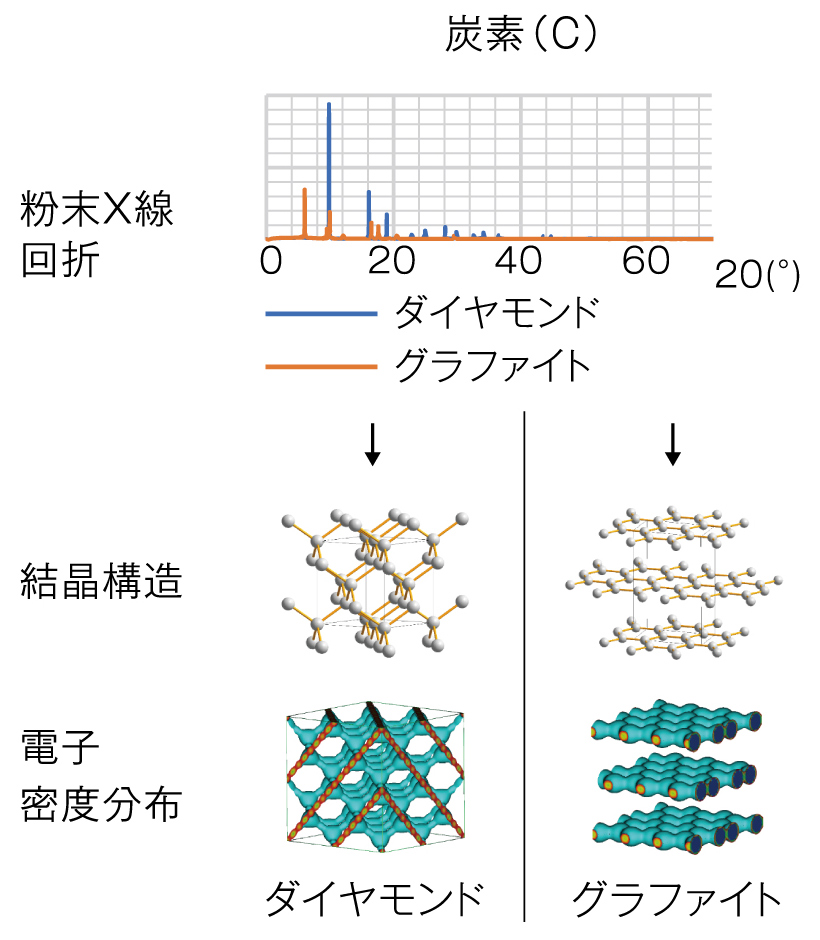
はい、X線を使った構造解析の研究をメインで行っています。X線のどこが良いかというと、原子や分子の間の距離がX線の波長とほぼ同じで干渉しやすいことです。
収集した強度データを解析すると、分子や原子の3次元の立体構造がわかるところが一番面白いところです。中学や高校で習う「光の回折」ってありますよね。あれは回折格子があり、干渉が起こって縞ができる。一方、結晶では原子の並びが回折格子になります。それで光が原子と原子の間を通ったときに、強め合うものと弱め合うものが出てきて、回折像として絵が出てくる。これを解析しています。
さらに、回折像に強弱があるのはなぜかというと、回折格子となる原子はX線を散乱する能力がそれぞれ異なり、電子をたくさん持っている原子のほうがX線を強く回折します。散乱する能力は電子の数で決まっているので、結晶の中の炭素などの軽元素は弱く、金属などの重元素は強い回折強度が得られます。
実際には、いろいろな原子や分子が3次元に並んでいるので、それらの足し合わせで回折像は出てきます。
PE 可視光のように太陽光というわけにはいかないので、X線を使うには高度な実験施設が必要ですよね。
杉本
普段の実験は兵庫県にあるSPring-8という大型放射光施設で行っています。アイセムスのラボではなくどうしてSPring-8でしているかというと、僕がいま取り組んでいる研究が物質内の電子の振る舞いを可視化することだからです。
そのためには非常に強く、安定したX線が必要です。全体の数%しか寄与しない電子の部分を立体として正確に可視化するのはなかなかラボでは難しいです。誤差の少ないデータを収集するために、ラボよりもっと短い波長のX線を使うことのほうが多いので、SPring-8でなくては実験できません。
PE 波長が「短い」とのことですが、具体的にはどれくらいの長さですか。

杉本
だいたい0.3〜0.4Å(1Åは10nm)の波長のX線を使います。
この長さの光を使うのは、「透過力がよい」というのが理由です。人体の輪切り画像で使われるCT画像は物質により異なるX線の吸収の差で生まれるコントラストによって得られるのですが、X線構造解析では試料によるコントラスト(=X線の吸収)があると、その分、強度に誤差が出てしまいます。そのコントラストをなくすために、短い波長のX線を使っています。
コントラストはあった方が観察しやすいと勘違いされるかもしれませんが、私たちのX線構造解析の研究で材料を見るときは、試料によるX線の吸収はないほうが精度の高い解析ができます。もちろんCT画像を使って診断される先生方は、得られる画像にコントラストがないと困ると思います。
同じX線を使っていても見たいものによってX線の使い方が違いますね。最近は、藤原先生と同様に僕たちも動いているところを観察することに重点を置いています。
PE 一分子を見ておられる藤原先生のように、一原子単位で動いている現象を見るのですか?
杉本
一原子単位で動いている現象をなかなか見ることはできないのですが、物質が機能を発現している動作下で測定し、構造を解析しています。そうすると先ほど藤原先生がおっしゃったように、どういったメカニズムで機能が発現しているのかがわかります。
物質の機能の発現はそんなに簡単には起こっておらず、いくつものステップを経て複雑に起こっていることが多いです。構造解析はそれを直接的に見られるところがいいところだと思います。
PE 動作下というのは、結晶が動くのですか。
杉本
動くこともあります。北川進先生が取り組まれている多孔性金属錯体(PCP)にガスを吸脱着させる研究もその1つです。ガスが細孔に入る過程では、やはり結晶は動きます。ゲートオープン型とおっしゃっているPCPでは、ガス分子が吸蔵される前後で構造が変わっています。ガス吸蔵される過程を短い間隔でスナップショットを撮っていくと、これまで理解していたガス吸蔵前後と異なる構造を通らないと次のステップに行かないことがわかったりします。
こういったメカニズムは、放射光を使わないとなかなか明らかにできないのかなと思います。
PE 藤原先生も高速で見るのは大事とおっしゃっていましたね。
藤原 どれくらいのスピードで撮っていますか? 現象によりますか?
杉本 理研・放射光科学研究センターにあるX線自由電子レーザー(XFEL)はfs(フェムト秒)、SPring-8はps(ピコ秒)の時間分解能で測定することができます。
PE SPring-8といえば、玉野井冬彦先生も使われています。
杉本
玉野井先生の研究室が開発されたシリカナノ粒子があり、50.25KeVのかなり短い波長のX線を照射するとそのナノ粒子から電子がはじき飛ばされて、その電子によって癌を死滅するという研究です。なぜか50.25KeVでないと作用しない。それよりも高いX線エネルギーを照射してもオージェ電子は発生しますが、それでは癌に作用しない。
原理的には50.3keVでも同じように電子が弾き飛ばし出されるので作用してもいいはずなのですが、癌には作用しなかった。なぜか50.25KeVのX線エネルギーを照射したときだけ癌に作用していて不思議です。照射しているX線が癌を攻撃するのではなく、X線によって発生したオージェ電子が使われているのです。50.25 KeV以上のX線を使えば電子は出てくるのだけど、それ以上のもの使うと死ななかったそうです。
なぜかよくわかってないから、玉野井先生に「ちょっと考えてよ」って言われているんです(笑)。
放射光施設のX線を用い、原子の構造を解析する
X線を用いた構造解析を行っています。中学や高校で習う「光の回折」ってありますよね。あれは回折格子があり、干渉が起こって縞ができる。この研究では、原子それぞれの並びが回折格子になります。それに対して、光とX線の幅がほぼ一緒なので、光が原子と原子の間を通ったときに回折像が出てきます。そこから導き出せる構造を解析しています。
接点は
「見たいものを光で可視化・視覚化」すること
PE
こうやって研究をお聞きすると、藤原先生のお仕事は光で1分子を見る、杉本先生も材料を見るということだと思います。
アイセムス内でも、光を扱って取り組んでいる研究はたくさんあります。
PE これらの研究は光を「利用する」ことに、お二人は「見る」ということに焦点が当てられています。
杉本 そうですね、私たちに共通するのは「見たいものを光で可視化・視覚化」するところだと思います。
藤原
ポイントは、それぞれの目的に合った波長を使うということですね。僕たちは分子とか細胞とか、大きいものを見るときに必要な光を使う。大きいものを見るのにX線を使っても仕方ないですから。目的の構造や機能を調べたいときに、「どのような光をどう使えば知りたいことを研究できるか」を考えます。
そういう意味では杉本先生は、可視光波長での光学顕微鏡はあまり使わないですか。
杉本 測定には使っていませんが、普通の実体顕微鏡は毎日使います。サンプル調製するときに使っています。
藤原 ではサンプル調製の道具として使っていると(笑)。
PE 材料系も細胞生物系も、サンプル調製には実体顕微鏡を使うのですね。アイセムス内で共同研究していることは何かありますか。
藤原 私が運営に携わっている解析センターのバイオ解析部門には共焦点顕微鏡や超解像顕微鏡があり、最近ではガネシュ・パンディアン・ナマシバヤム先生のテロメアの可視化の研究に役立てていただきました。
光を使って「観る」ことの楽しみ
PE 光を使って研究したり、観察したりすることの魅力はなんでしょう。

杉本
私はもともと学生時代には金属錯体の合成の研究をしていました。金属錯体はアイセムスの研究者の方々も使っていますが、まず構造がわからないと論文にならないので、構造を決める必要があります。大学の時は金属錯体の合成も楽しかったですが、構造を解析するのが一番面白かったので、大学卒業後、X線装置の企業に研究員として就職しました。
光を使って「観る」ことの一番の楽しみは、誰も見たことのない世界をX線を使って最初に見られるところですね。自分で作った金属錯体はもちろん、人から頼まれた結晶の構造も最初に見られます。電子の分布をパッと見てもすぐには構造がわからないので、パズルを解くようなかんじです。最初にパズルを解いて、自分が最初に見る。それこそ、北川進先生が見る前に僕が先に見られるのです(笑)。
藤原 金属錯体を観察するにはひらめきや、データをどういうふうに解釈するかということが大事になりますか?
杉本
そうですね。結晶中の原子は対称的に並んでできています。実際の解析では、構造を端から端まで全部を解析しているわけではないです。最も小さい単位の一部だけを理解して、それがある対称性をもっているので、周期的な“らせん”や“折り返し”などで繋げることで一つの構造を導き出します。
でも、たまにひらめかないとできないときもあります。
PE 「ここにこれが入るのかな?」と予測していくのですか。
杉本 そうです。この対称性だと「あ、これ六角形になるわ」とかです。
PE 空間のセンスが問われますね。
杉本 あと、ある程度、化学に詳しくないと構造を解析できません。結晶構造解析では「分子のここは炭素で、あれは窒素」と見えているわけじゃないです。原子の周りに広がる雲のような電子の密度の分布を見て、どの元素かを当てはめていく感じです。
PE すごく職人的な感覚が必要ですね。
杉本 化学的には「そんな反応は起こらない」とか「この元素とこの元素は結合しないはず」とか考えていき、絶対ありえない構造がでてくると、やはり解析し直さないといけないです。逆に推理がはまるとあっという間に解析できることもあります。
PE とても難しいですね。結局、最終的には職人技が構造を決めるということですか?
杉本 そういう側面もありますね。
PE センスが問われるって面白いですね。
杉本 藤原先生の観察も同じだと思います。ひらめきは大事な要素だと思います。
藤原
僕の場合は見たいものは決まっているけど、それ以外のものが山ほど見えてしまい、じゃまになったりする。見たいところだけをうまく照明して、見たいものの信号だけをうまく取り出しています。
あと、運動からいろいろなことを調べます。観察しているのは液体中の世界なので、ブラウン運動に近い乱雑な動きが基本です。その中で「ちょっと変わった運動をしている」、「止まった」、「集まった」などの動きを探しています。
見たことのない人が1分子の運動を見たらわけがわかんないと思います。
PE どこをどう見たらいいかわからなさそう(笑)。
藤原 ちらっと、違う運動しているものがヒョコっとでてくる(笑)。
PE 「あ、これだ」というのが、ちょっとわかるわけですね。
藤原
生物が細胞を集めて何か構造を作るとき、分子の分布の偏りで、その前後や上下の軸になる方向を決めています。しかし、分子の世界では熱運動が基本です。やたらめったら動き回るのをうまく集めるとか、決まった方向に運ぶとかしないと、軸を決めることはできません。分子の熱運動をうまく制御して、乱雑な中に秩序を与えて、初めて細胞が機能します。例えば膜を使えば、三次元の動きを二次元に抑えることができる。細胞の中だと、ATPエネルギー依存的な分子モーターを使って、細胞骨格に沿った一次元の運動でものを運んでいます。
そういう仕組みを1分子のレベルで調べるとき、高速で見ないとどういうふうに働いているのかが見えないことが多い。ノイズの非常に多い細胞中で1分子の弱い信号を高速で取り出して、どうやって制御しているかを調べるのが面白いところでもあり、とても難しいところ。僕たちは細胞内での「世界一の蛍光1分子高速観察」をいつも目指していて、そのための技術をずっと追求しています。
PE 「いつかこれが見てみたいな」というものはありますか。
藤原 細胞膜分子の運動を限界の速さで見たい。でも、二次元の拡散運動という意味では限界に近いとこまで見えてきています。二次元で動く距離と分子自体のサイズがだんだん近づいてきているので、分子自体の構造のゆらぎとの区別が難しくなってくるのですけど、でも限界までいきたい。
PE 見られたら面白いですよね。杉本先生はなにか見てみたいものはありますか?
杉本 フェムト秒でいろんな現象を観察してみたいです。でも、SPring-8では、なかなか難しいです。FELのほうでは、装置の開発が先行していますが(笑)。
藤原 僕も装置は、もう少し速いとこまで見えるのだけど、信号が足らない。

PE
ボトルネックになるところをなくしながら、全ての条件が揃わないと観られないということですね(笑)。
ありがとうございます。お二人のご研究の発展を期待しております。