細胞死の目印の動態を解明
特定助教(鈴木グループ)
圓岡 真宏
Masahiro Maruoka
生体では新しい細胞が生まれると同時に、使われなくなった古い細胞は死を迎えることで恒常性が保たれています。死んだ細胞では、その目印となるホスファチジルセリンという脂質が細胞表面に提示され、食細胞はそれを認識して除去します。今回、圓岡さんと鈴木教授らは、細胞に死が訪れた際の脂質動態の制御機構を明らかにしました。

今回の論文の中で、最も伝えたかったこと(達成できたこと、インパクト、ユニークな点など)を教えてください。
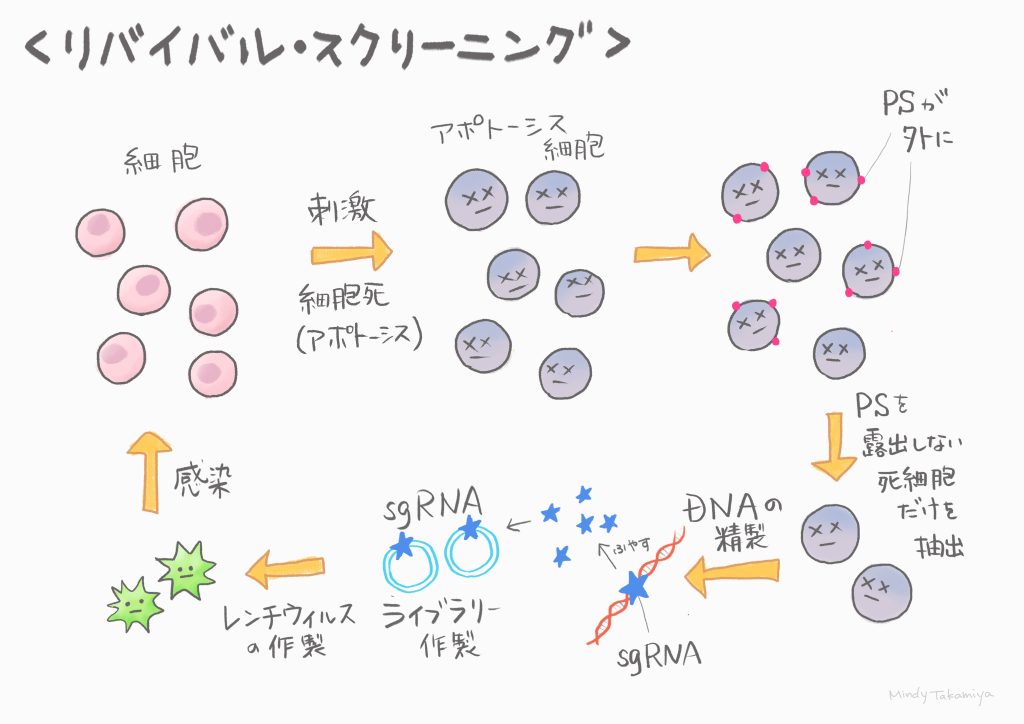
生体内では、古くなった不要な細胞は細胞死(アポトーシス)を起こして除去されます。この過程で、細胞膜の表面ではホスファチジルセリン(Phosphatidylserine:PS)というリン脂質が細胞表面に提示され、食細胞はこれを認識して死細胞を食べています。私たちの研究室では、この脂質の露出に関わるスクランブラーゼを同定し、その機能解析を行ってきました。今回私は神経細胞特異的に発現するXkr4というスクランブラーゼの活性制御機構を解明するため、その活性制御因子の同定を試みました。スクランブリングはアポトーシス刺激によって誘導することができますが、スクランブリング活性を指標にスクリーニングを行うと、細胞は死んで無くなってしまいます。そこで私は網羅的な遺伝子破壊を可能にするCRISPR/Cas9 sgRNAライブラリーを用いて、死にゆく細胞からでも候補遺伝子の同定を可能とする“リバイバルスクリーニング法”を新たに開発しました。結果として、私は核内のDNA修復複合体の1つであるXRCC4をXkr4の制御因子として同定しました。この結果は、不要な細胞の除去のシグナルが核内から直接、細胞膜に伝達されるというこれまでの常識を覆すものです。この仕組みの理解により、神経変性疾患などを防ぐための新たな手掛かりとなることを期待しています。
今回の研究における最大のチャレンジ、困難は何でしたか?それをどうやって乗り越えましたか?
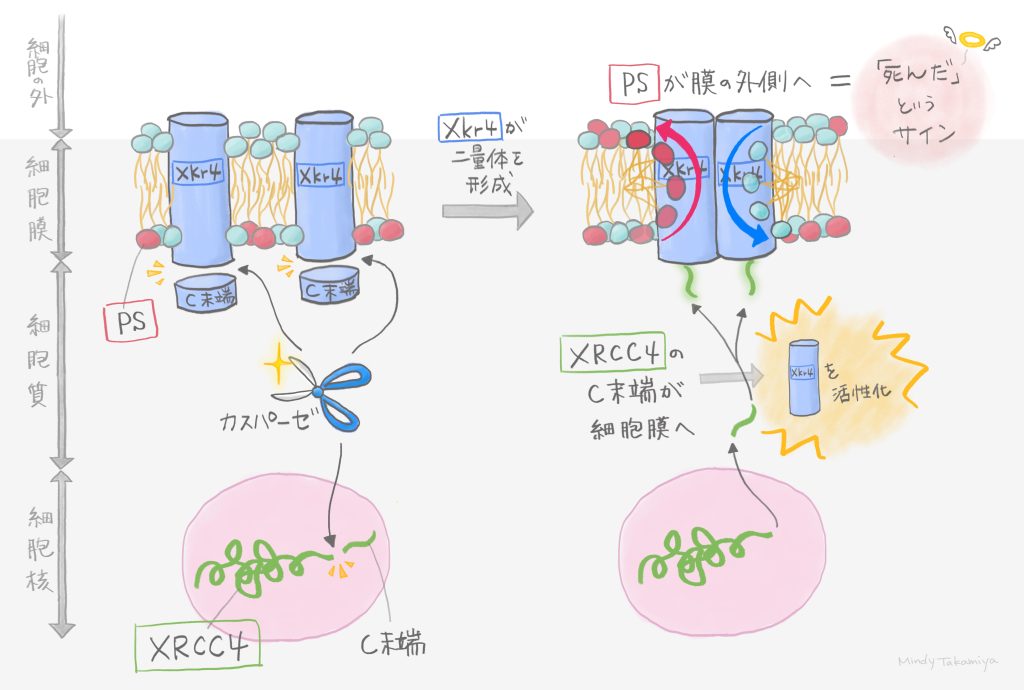
今回の研究では、新しいスクリーニング系を立ち上げたこともチャレンジでしたが、候補遺伝子として得られたXRCC4を解析すること自体もチャレンジだったと思います。なぜなら、XRCC4はDNA修復複合体の一つなので、当然のことながら核内に存在しています。一方Xkr4は細胞膜にしか存在していません。このように分子の局在は全く異なっていたので、普通に考えるとこれらの分子が協調して働くとは思えませんでした。不安を抱きながらも解析を進めて行くと、1)XRCC4はアポトーシス時に活性化するカスパーゼで切断されるということ、2)切断された断片の一部が細胞質側に放出されること、3)その放出された断片が細胞膜のXkr4に結合すること、が分かってきました。論理的にスクリーニング系を構築し、先入観や常識にとらわれずに一つひとつ丁寧に解析していくことで答えが導かれたと思います。
今回の研究で、一番嬉しかった、もしくは感動した瞬間を教えてください。
仮説を直接的な実験で証明した時です。XRCC4の断片はXkr4と結合したので、この相互作用がXkr4によるスクランブリング活性に寄与するという仮説を立てました。これを証明するために、活性化に必要なXRCC4の最小ペプチド領域を見つけ、そのペプチドを直接細胞に放り込んでやると、アポトーシスを誘導しなくてもそれだけでXkr4が活性化することが分かりました。この結果をもって仮説が証明され、嬉しかったのと同時に、スクリーニングの結果が正しかったことに安堵したのを覚えています。
今回の研究で学んだことは、あなたの研究人生、研究の方向性のターニングポイントになったと思いますか?もしそうならば、どの様に変わったのかを教えてください。
ヒトの遺伝子の数はおよそ2万個と考えられています。私はこちらに着任するまで、ほとんどの遺伝子の機能はだいたい分かっているものと思い込んでいました。ところがスクリーニングをしてみると、機能未知遺伝子のほうが大多数であることに気づかされるだけでなく、今回の私の研究では、すでに機能が十分解明されたと考えられていたXRCC4にさえも未知の機能があることを発見しました。このような経験は、生命現象を理解するうえでスクリーニングの重要性に気付かされたという点で非常に大きなターニングポイントになったと思います。スクリーニングにより生命現象を解明しようとしていく姿勢は私の今後の研究人生においても常に意識して進めて行くことになると思います。
現在のあなたのポジション、仕事環境を教えてください。iCeMSでの研究を通して得た、知識や経験などはキャリア形成にどのような影響を与えましたか?
私は現在も引き続きiCeMS鈴木研究室で特定助教として研究を行っています。自分で実験を行い、学生の指導も行います。リバイバルスクリーニングにおいては国内外の研究者が興味を持つ現象に関わる新しい因子の同定を目指し共同研究も進めています。iCeMSでは生物学だけでなく物質科学、化学、数学などの様々なバックグラウンドを持つ人が研究に携わっており、共同で研究を進める機会に恵まれています。また、最新の共通機器が使用可能なだけでなく、それを支える解析センターのサポート体制も充実しています。このような恵まれた環境の中で研究を遂行できることに感謝して、今後のキャリアにつなげられるよう頑張りたいと思っています。
※研究者の所属などは、取材当時のものです。
論文情報
Caspase cleavage releases a nuclear protein fragment that stimulates phospholipid scrambling at the plasma membrane
Masahiro Maruoka, Panpan Zhang, Hiromi Mori, Eiichi Imanishi, Daniel Packwood, Hiroshi Harada, Hidetaka Kosako, Jun Suzuki
Molecular Cell
Published: March 2020
DOI: 10.1016/j.molcel.2021.02.025