細胞外カルシウムが不要細胞除去に重要!細胞膜貫通領域をつなぐ新たな役割の発見
北海道大学大学院理学研究院 博士研究員
※本研究を行っていた当時は大学院生(鈴木グループ)
Panpan Zhang
Panpan Zhang
私たちの体では、毎日数千億の細胞がその役目を終えて死に至ると、貪食細胞によって速やかに取り除かれます。死んだ細胞では、その表面に細胞膜の脂質の一種であるホスファチジルセリンが露出し、これを目印にして貪食細胞が貪食します。今回、Panpan Zangさんは、ホスファチジルセリンがどのようにして細胞の表面に現れるのか、そのメカニズムを解明しました。また、カルシウムによる細胞膜タンパク質の新たな制御機構も発見しました。

今回の論文の中で、最も伝えたかったこと(達成できたこと、インパクト、ユニークな点など)を教えてください。
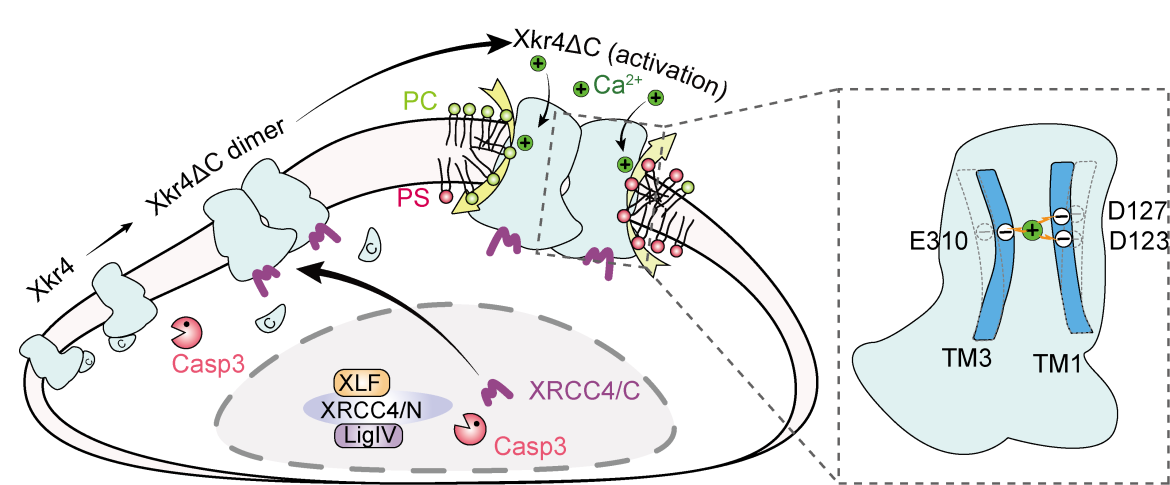
Xkr4は、細胞膜を構成する脂質二重層の内層と外層の脂質を両方向への移動を促進するスクランブラーゼという分子の一つです。鈴木グループでは、Xkr4がカスパーゼによるC末端の切断後に二量体化し、XRCC4タンパク質のC末端(XRCC4/C)と直接結合することによって活性化されることを明らかにしています。しかし、二量体形成とXRCC4/Cの結合だけではXkr4を完全に活性化することはできません。今回の研究で私は、Xkr4の活性化にはカルシウムが重要な役割を果たすことを明らかにしました。
カルシウムは、タンパク質の機能を調節するためのセカンドメッセンジャーとして働きます。通常、細胞外のカルシウムは細胞膜のタンパク質の表層面に結合して機能します。しかし、私たちの研究では、細胞外カルシウムがXkr4の中央付近の膜貫通領域に結合し、Xkr4を活性化することがわかりました。さらに、カルシウムがXkr4の活性化を引き起こすメカニズムを解明するため、2つのシステイン(アミノ酸)がつながるジスルフィド結合や、酸性と塩基性アミノ酸の間で生じる塩橋など、人工的に架橋させるような変異を膜貫通ドメインに導入すると、カルシウムが無くてもXkr4が活性化することが判明しました。これにより、カルシウムがXkr4の膜貫通部分をつなぐための架け橋として機能する、いわば分子の接着剤として作用することが示されました。この結果は、これまでに知られていない膜貫通型タンパク質の制御メカニズムを明らかにしたことになります。
今回の研究で、一番嬉しかった、もしくは感動した瞬間を教えてください。
スクランブラーゼの活性化により、細胞膜のテンション(膜の張力)が変化します。そこで、Xkr4へのカルシウムの結合を証明するため、細胞膜のテンションを測定するというアイデアが浮かびました。細胞膜のテンションは、細胞をガラス面に接着させ、さらに膜表面に付着したビーズを物理的に引っ張ることによって測定できます。しかし、私が使用したBaf3細胞は血液由来の細胞であるため接着性が乏しく、これらの細胞がディッシュの表面にしっかりと付着できず、長時間の測定中に細胞がはがれてしまうという課題がありました。分析条件を最適化するだけで6ヶ月以上かかりましたが、この実験を通じて、私は成功には大きな忍耐と困難を克服するための粘り強さが必要であることを学びました。
今回の研究における最大のチャレンジ、困難は何でしたか?それをどうやって乗り越えましたか?
今回の研究で最も難しかったのは、カルシウムの結合がどのようにXkr4を活性化するかを理解する点にありました。Xkr4とカルシウムとの相互作用を直接測定するため、Xkr4の精製を試みましたが、Xkr4は不安定なため精製することが難しかったのです。最終的に、私はとてもすばらしいアプローチを見つけることができました。
私の研究では、カルシウムがXkr4膜貫通領域1と3上にある負に荷電したアミノ酸残基に結合し、2つの膜貫通領域をつなげる橋渡しとして機能すると予測しました。このカルシウムによる橋渡しを再現するため、私たちはこれらのカルシウムと相互作用する残基の変異を作成しました。たとえば、私たちはシステイン変異を利用してジスルフィド結合を導入したり、正に荷電したアミノ酸であるリジン/アルギニンの変異を利用してカルシウムと相互作用する残基(負に荷電した残基:アスパラギン酸/グルタミン酸)との塩橋を導入しました。このような人工的なクロスリンカーを使用することで、私たちはカルシウムが存在しない状態でもXkr4を活性化することができました。したがって、Xkr4へのカルシウム結合が分子的な接着剤として機能し、活性化されたXkr4における膜貫通領域間をつなげる役割を担っていることがわかりました。
今回の研究で学んだことは、あなたの研究人生、研究の方向性のターニングポイントになったと思いますか?もしそうならば、どの様に変わったのかを教えてください。
2018年に鈴木グループに入って以来、細胞死と人間の健康との関連の理解を目指してスクランブラーゼを研究してきました。とても興味深く重要な分野なので、将来にわたってこの分野で研究を続けたいと思っています。鈴木グループでは、貴重な細胞生物学の経験を積むことができました。修士課程の学生のとき、私はタンパク質の構造解析に夢中でした。クライオ電子顕微鏡の発達により、私たちはタンパク質が変化し、生命を維持するために不可欠な機能をどのように果たしているかを観察することができます。今後、アイセムスで得た経験や知識をもとに、膜タンパク質構造の探求を続けていきたいと思います。
現在のあなたのポジション、仕事環境を教えてください。iCeMSでの研究を通して得た、知識や経験などはキャリア形成にどのような影響を与えましたか?
私は2024年の4月にアイセムスから北海道大学大学院、理学研究院へ研究の場を移しました。アイセムスは、素晴らしい研究環境と豊富なリソースが備わっており、多くの国から研究者が集まる国際的な研究所です。さらに、アイセムスはOn-site Laboratory(海外研究機関との共同運営ラボ)を強力に推し進めており、海外研究者とのコラボレーションが進みやすい環境にあります。特に台湾にあるOn-site Laboratoryの統合バイオシステムセンターを訪問するチャンスを得られたことに感謝しています。アイセムスでの5年間は、博士課程の研究者としての私のキャリアにとって重要なフェーズであり、包括的なトレーニングを受け、国際的な視点で研究にアプローチする方法を学ぶことができました。アイセムスで得た経験が、私の研究キャリアに必要なスキルと自信を与えてくれたと感じています。
最後に、iCeMSで現在も研究を行っている若手研究者(ポスドク、学生)にメッセージをお願いします。
ステップごとに自分の頭で考えながら、ぜひ、いいアイデアをもらえそうな人とは遠慮なくコミュニケーションを取ってください。
論文情報
Extracellular calcium functions as a molecular glue for transmembrane helices to activate the scramblase Xkr4
Panpan Zhang, Masahiro Maruoka, Ryo Suzuki, Hikaru Katani, Yu Dou, Daniel M. Packwood, Hidetaka Kosako, Motomu Tanaka, and Jun Suzuki
Nature Communications
Published: September 2023
DOI: 10.1038/s41467-023-40934-2